Um ácido, em solução aquosa, aumenta a concentração dos iões hidrónio (\(\text{H}_{3}\text{O}^{+}\)) e uma base, em solução aquosa, provoca o aumento dos iões hidróxido (\(\text{OH}^{-}\)). Como as concentrações destes iões estão relacionadas entre si (quando uma aumenta a outra diminui) é possível utilizar apenas uma delas para determinar o carácter ácido ou básico de uma solução.
A escala de \(\text{pH}\) de Sørensen
Sørensen propôs uma escala baseada na concentração do ião hidrónio, para determinar a acidez de uma solução:
$$\text{pH}=-log[\text{H}_{3}\text{O}^+]$$
em que a concentração do ião hidrónio é expressa em mol dm-3.
Quanto mais forte for um ácido, maior será a concentração de iões \(\text{H}_{3}\text{O}^{+}\) na solução.
A escala de \(\text{pH}\) (Figura 1) tem como limite superior, a 25 °C, o valor 14 (devido ao valor do \(K_{W}\) da água a essa temperatura).
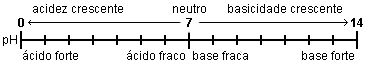
A 25 °C, se \([\text{H}_{3}\text{O}^{+}]\) = 1,0 x 10-7 mol dm-3, a solução terá \(\text{pH}\) = 7.
Solução ácida: \([\text{H}_{3}\text{O}^{+}]\) > 1,0 x 10-7 mol dm-3, \(\text{pH}\) < 7 (a 25 °C)
Solução neutra: \([\text{H}_{3}\text{O}^{+}]\) = 1,0 x 10-7 mol dm-3, \(\text{pH}\) = 7 (a 25 °C)
Solução básica: \([\text{H}_{3}\text{O}^{+}]\) < 1,0 x 10-7 mol dm-3, \(\text{pH}\) > 7 (a 25 °C)
Cálculo da concentração de hidrónio a partir do \(\text{pH}\)
A função inversa do logaritmo de base 10 permite calcular a concentração de \(\text{H}_{3}\text{O}^{+}\) a partir do valor do \(\text{pH}\):
$$[\text{H}_{3}\text{O}^+]=10^{-\text{pH}}$$
Escala de \(\text{pOH}\)
O \(\text{pOH}\) é definido em relação à concentração do ião hidróxido tal como o \(\text{pH}\) é definido em função da concentração do hidrónio, ou seja:
$$\text{pOH}=-log[\text{OH}^-]$$
Relação entre \(\text{pH}\) e \(\text{pOH}\)
O limite máximo da escala de \(\text{pH}\), para cada temperatura, é a soma ente o \(\text{pH}\) e o \(\text{pOH}\) da solução.
À temperatura de 25 °C:
$$\text{pH}+\text{pOH}=14$$
Desta relação:
Solução ácida (a 25 ºC):
\(\text{pH}\) < 7
\([\text{H}_{3}\text{O}^{+}]\) > 10-7 mol dm-3
\([\text{OH}^{-}]\) < 10-7 mol dm-3
Solução básica (a 25 ºC):
\(\text{pH}\) > 7
\([\text{H}_{3}\text{O}^{+}]\) < 10-7 mol dm-3
\([\text{OH}^{-}]\) > 10-7 mol dm-3
Tabela 1 - \(\text{pH}\) de soluções conhecidas [1].
|
Solução |
\(\text{pH}\) |
|
Ácido de bateria |
1,0 |
|
Suco gástrico |
1,6 a 1,8 |
|
Sumo de limão |
2,2 a 2,4 |
|
Sumo de laranja |
2, 4 a 2,6 |
|
Coca Cola |
2,6 |
|
Vinho |
2,8 a 3,6 |
|
Vinagre |
3,0 |
|
Sumo de uva |
4,0 |
|
Água com gás |
4,0 |
|
Tomate |
4,3 |
|
Cerveja |
4,0 a 5,0 |
|
Queijo |
4,8 a 6,4 |
|
Urina |
4,8 a 7,5 |
|
Café |
5,0 |
|
Chuva normal |
5,5 a 6,5 |
|
Saliva humana |
6,3 a 6,9 |
|
Leite de vaca |
6,6 a 6,9 |
|
Água bidestilada |
6,7 |
|
Sangue |
7,3 a 7,5 |
|
Lágrima |
7,4 |
|
Clara de ovo |
8,0 |
|
Água do mar |
8,0 |
|
Sabonete |
10 |
|
Leite de magnésia |
10,5 |
|
Água de Javel (lixívia caseira) |
11 |
|
Limpa vidros |
12 |
|
Limpa fornos |
13 a 14 |
 Acidificação da água
Acidificação da água Soluções Ácido-base [© PhET]
Soluções Ácido-base [© PhET] Escala de pH [© PhET]
Escala de pH [© PhET]
Bibliografia
[1] T. S. Simões, M. A. Queirós, M. O. Simões, "Técnicas Laboratoriais de Química – Bloco II", Porto Editora, Porto, 2003.
